
Dal trasferimento di conoscenze al ragionamento approfondito
Testo: Dr. Kay-Uwe Hanusch
Foti: Haute école spécialisée bernoise (BFH)
Negli ultimi anni si è assistito a un cambiamento di paradigma nella comprensione del dolore, con conseguenze di vasta portata per terapia e pratica. Nella sua definizione di dolore, l’International Association on the Study of Pain (IASP) distingue tra nocicezione (stimoli che provocano dolore) e percezione (esperienza del dolore). Nella pratica clinica è quindi necessario misurare e documentare entrambe.
I fisioterapisti in genere usano la scala analogica visiva (VAS, 100 mm) o la scala di valutazione numerica (NRS, 0-10) per valutare l’esperienza del dolore. Secondo il consenso internazionale (Initiative on Methods, Measurement, and Pain Assessment in Clinical Trials o IMMPACT), i valori limite della scala sono 0 (nessun dolore percepito) e 10 (il dolore più forte che si possa immaginare). La riduzione del dolore è considerata clinicamente rilevante solo se varia di almeno il 30% (Dworkin et al., 2009).
La valutazione della sola percezione soggettiva non è però più sufficiente nel caso di dolore cronico. È necessario considerare anche gli stimoli nocicettivi e strategie come la resistenza o l’evitamento. Tuttavia, non esiste ancora un metodo consolidato per misurare la nocicezione in fisioterapia.
Nella ricerca neurologica sul dolore neuropatico la valutazione della sensorialità e della nocicezione è oramai consolidata (Magerl et al., 2010; Treede, 2013). In questo campo si usa il test sensoriale quantitativo (QST) che consiste nell’applicare ai pazienti stimoli termici o meccanici, sensoriali e nocicettivi standardizzati. I pazienti valutano l’intensità degli stimoli (ad es. 0 = nessun dolore, 10 = il dolore più forte che si possa immaginare) o la percezione degli stimoli (ad es. dolore percepito/non percepito, sordo/acuto, ecc.).
Da questi dati si possono ricavare specifici fenotipi di dolore – come la perdita sensoriale, l’ipersensibilità meccanica o termica (Forstenpointner et al., 2018; Vollert et al., 2017), utili per prescrivere terapie farmacologiche specifiche. Questi fenotipi aprono importanti prospettive per la fisioterapia: le misure fisioterapiche potrebbero essere adattate in modo più specifico ai cosiddetti profili responder, cioè ai pazienti che rispondono particolarmente bene a determinate forme di terapia.
Negli ultimi anni questo tipo di test (diagnostica presso il punto di cura o di assistenza del paziente, chiamata anche bedside testing o point-of-care testing) è stato ulteriormente sviluppato in forma semplificata per la pratica clinica (Koulouris et al., 2020; Reimer et al., 2020; Sachau et al., 2023; Sachau & Baron, 2023) aprendo interessanti possibilità di misurazione della nocicezione anche nel dolore muscoloscheletrico.
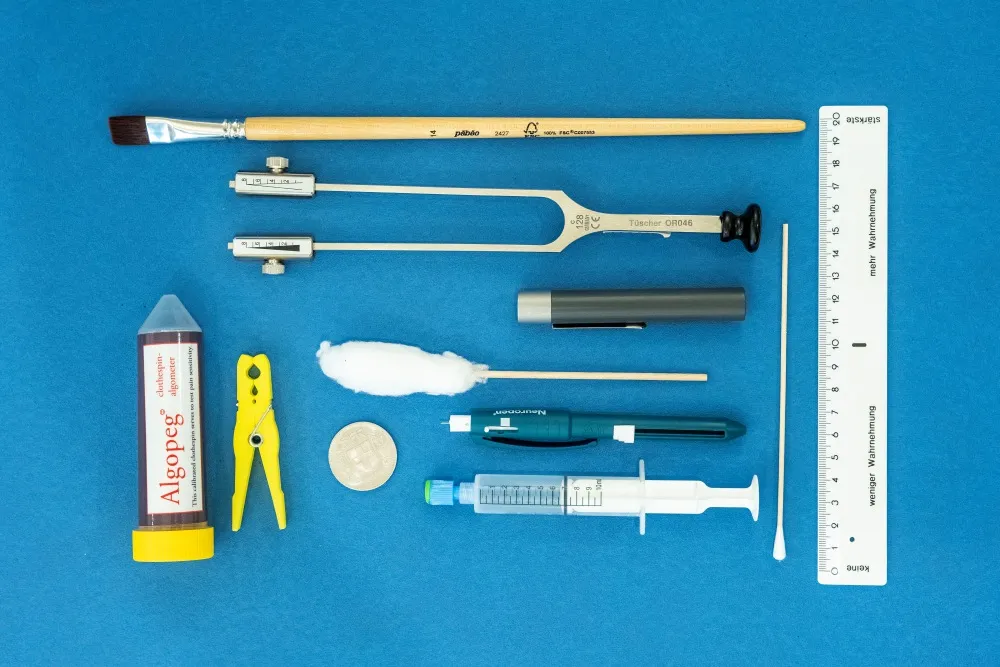
L’Università di Scienze Applicate di Berna (BFH) ha sviluppato un test clinico sensoriale-nocicettivo basato su Reimer et al. (2020) che include 13 sottotest standardizzati, ognuno dei quali viene eseguito nell’area del dolore: tre per rilevare la sensorialità e dieci per valutare gli stimoli nocicettivi. Ai pazienti viene chiesto di classificare uno stimolo come doloroso non appena percepiscono una sensazione lancinante, perforante, bruciante o dolorosa.
Per valutare la percezione termo-sensoriale si usa un «TipTherm», uno strumento con un’estremità calda e una fredda. Si applicano in ordine casuale tre stimoli freddi e tre stimoli caldi nell’area di test. Ogni stimolo dura circa tre secondi. I pazienti indicano se percepiscono lo stimolo come freddo, caldo o molto caldo. Una percezione corretta equivale a 1, mentre una percezione errata a 0. Se uno stimolo freddo viene percepito come caldo, si parla di sensazione paradossale di caldo (PHS).

Per rilevare gli stimoli termo-nocicettivi si usa un pezzo di metallo di 3 cm2 (ad es. una moneta da cinque franchi) riscaldato a 45°C in uno scaldapappe o scaldabiberon (BY52 di Breuer) o raffreddato a 8°C in un frigorifero (Fdit Mini USB) e poi collocato nell’area di test per tre secondi. Ai pazienti viene chiesto di indicare se percepiscono lo stimolo come doloroso (sì/no). Se la risposta è «sì», indicheranno anche l’intensità del dolore su una scala da 0 (nessun dolore) a 10 (il dolore più forte che si possa immaginare).

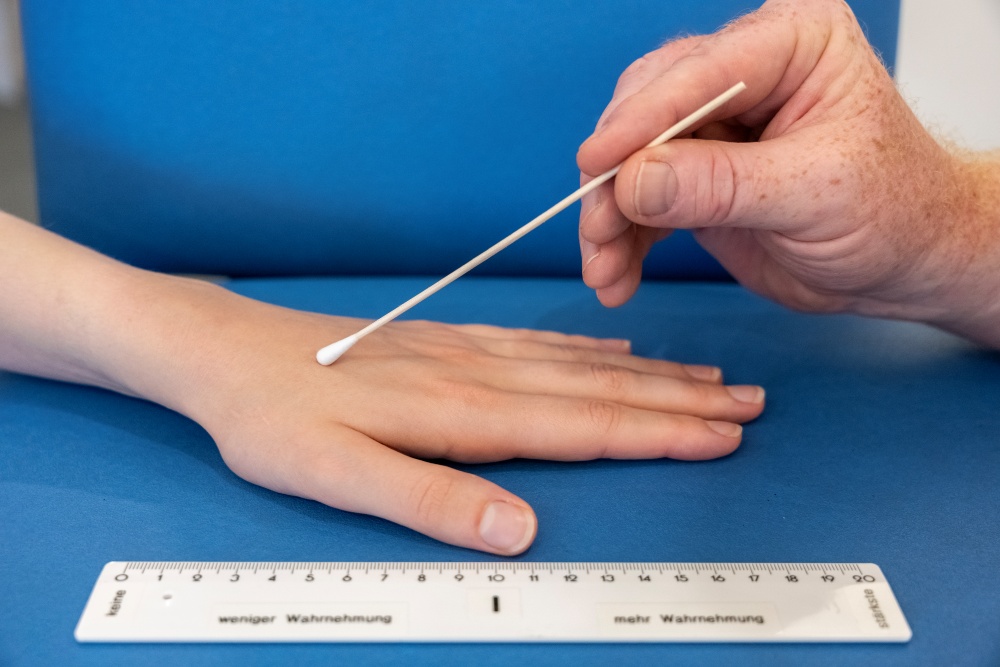
Per valutare la sensibilità tattile si passa un bastoncino cotonato su 5 cm di pelle sia nell’area di test che in quella di controllo. I pazienti valutano la percezione su una scala da 0 (nessuna percezione) a 20 (percezione massima) con 10 come valore normale nell’area di controllo speculare.
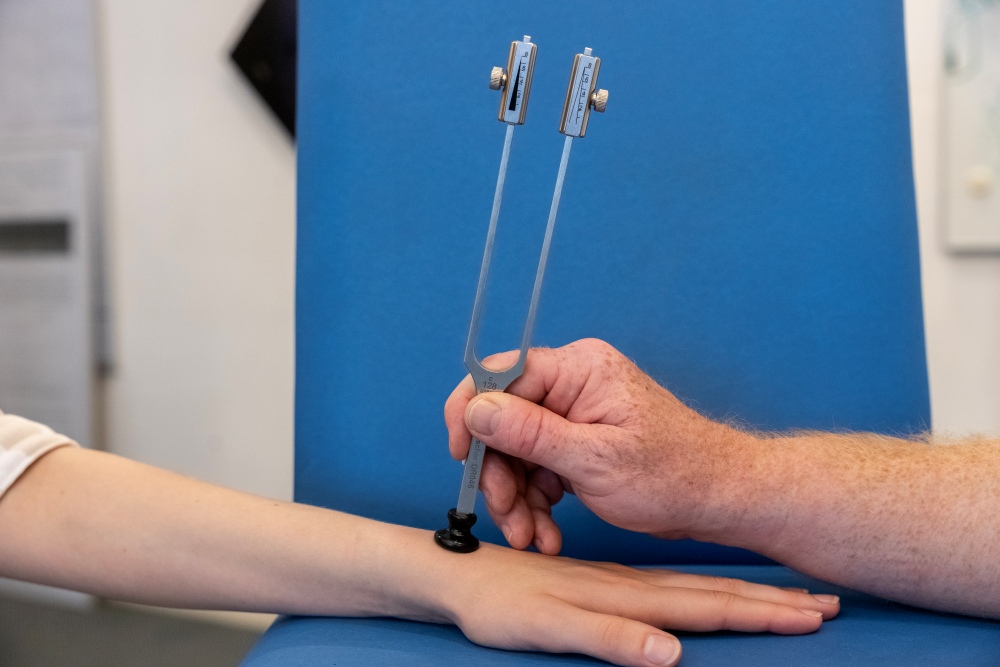
Per misurare la capacità di percepire le vibrazioni si usa invece un diapason C64/128Hz in prossimità di sporgenze ossee vicine all’area di test. La scala va da 0 (nessuna percezione) a 8 (percezione delle vibrazioni).
Pour tester la sensibilité mécanique nociceptive, on utilise un «Neuropen» (400 mN) muni d’une pointe «Pinprick». Les patient·e·s indiquent s’ils ressentent la piqûre comme douloureuse. En cas de réponse positive, l’intensité de la douleur est ensuite évaluée sur une échelle de 0 à 10. La sommation temporelle de la douleur est ensuite testée de manière similaire: la même piqûre est appliquée dix fois au même endroit, en l’espace de dix secondes. L’intensité de cette stimulation répétée est ensuite comparée à celle de la stimulation unique, en divisant la première par la seconde.
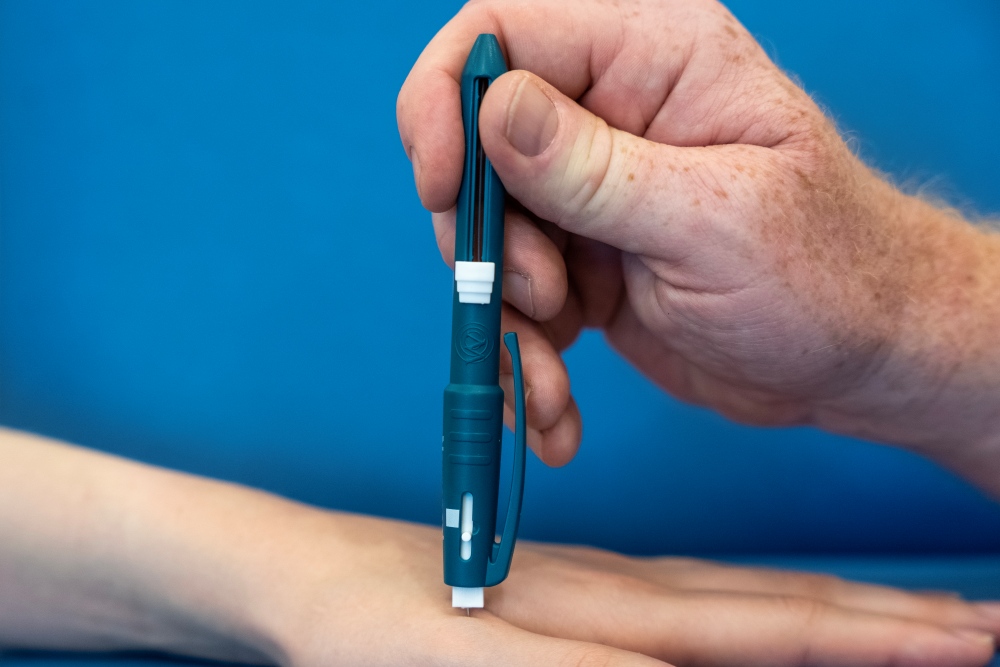
Per testare la sensibilità nocicettivo-meccanica si usa una «Neuropen» (400mN) dotata di punta. I pazienti segnalano se percepiscono la pressione come dolorosa. In caso affermativo, valutano l’intensità del dolore su una scala da 0 a 10, dopodiché viene testata la somma temporale del dolore con un test di pressione ripetuto nello stesso punto per dieci volte nell’arco di dieci secondi. L’intensità del dolore rilevata con la misurazione in serie viene divisa per l’intensità della singola stimolazione.

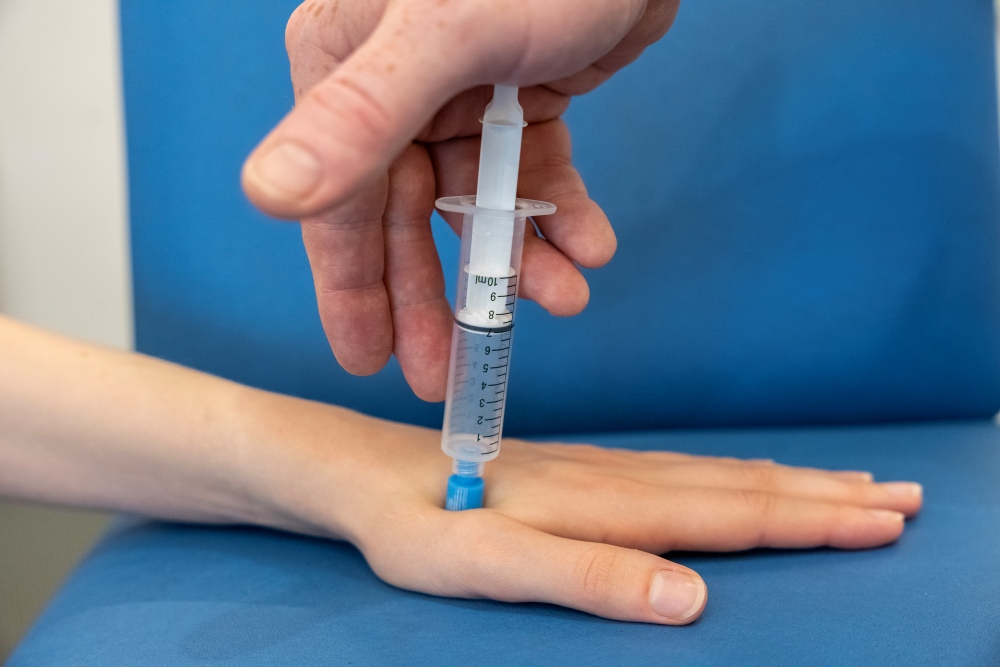
Per misurare la sensibilità alla pressione si usa una siringa Luer Lock da 10 ml senza ago dotata di un tappo di 1 cm2 rivestito di gomma. Dopo aver tirato il pistone fino alla tacca dei 10 ml, si tiene la siringa con il tappo in posizione verticale su un muscolo dell’area di test e si comprime l’aria 1 ml al secondo finché il soggetto non percepisce la pressione come dolorosa. Il valore misurato in millilitri è la soglia nocicettiva.
Per misurare l’estensione del dolore, il test viene eseguito sui muscoli anche in due punti diversi dei quattro quadranti del corpo (estremità superiore e inferiore sia destra che sinistra).
Il test Algopeg serve a riconoscere eventuali alterazioni corticali nella percezione del dolore. All’orecchio del soggetto si lascia attaccata una molletta standardizzata con una forza di 10 newton per dieci secondi. Il soggetto valuta l’intensità del dolore su una scala da 0 a 10.

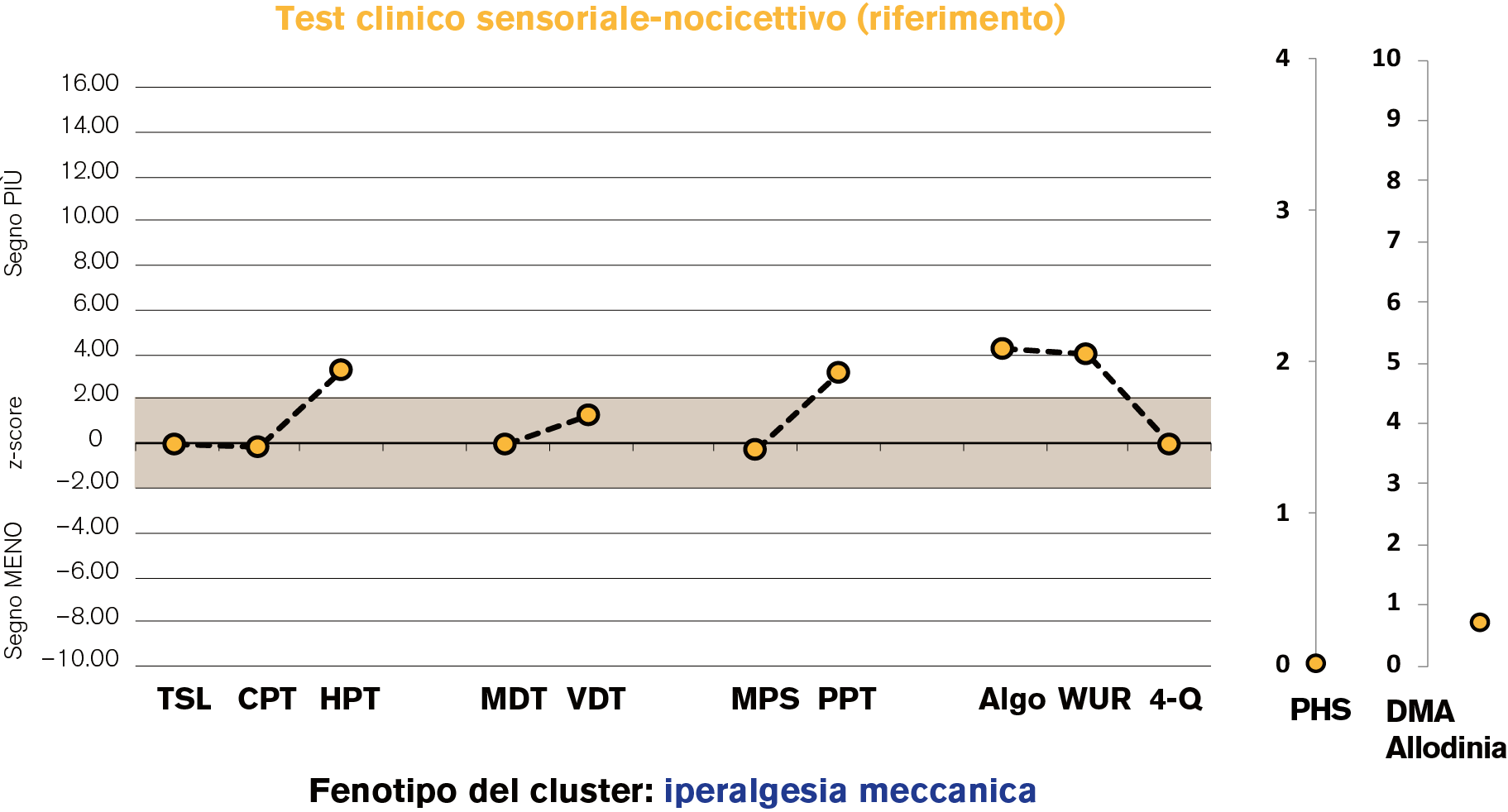
Per rendere comparabili i risultati delle 13 diverse misurazioni e individuare le deviazioni dalla norma, per ogni test eseguito viene calcolato un cosiddetto valore z. I valori z indicano quanto un singolo valore misurato si discosta dal valore medio di riferimento:
Formula:
z = (valore del test – valore medio di riferimento) / deviazione standard del valore di riferimento
Interpretazione:
Esempio:
Valore misurato con la siringa Luer Lock: 7,5 ml
Valore medio di riferimento: 4,1 ml
Deviazione standard: 1,4 ml
z = (7,5 – 4,1) / 1,4 = 2,4 → notevole sensibilità
I valori di riferimento usati provengono da studi neurologici con gruppi di controllo sani (cf. Tabella 1). In caso di sintomi unilaterali, anche i valori rilevati sul lato sano del corpo possono fungere da valori di riferimento. A fini di chiarezza è utile una rappresentazione grafica dei risultati, ad es. con un diagramma a linee con intervallo di riferimento (deviazioni standard ±2).
| Abbreviazione | Valore medio | Deviazione standard | Fibra | |
| Percezione della temperatura | TSL | 6.00 | 0.50 | Aδ, C |
| Sensazione paradossale di caldo | PHS | 0.00 | 0.00 | Aδ, C |
| Dolore da freddo | CPT | 0.10 | 0.50 | C |
| Dolore da caldo | HPT | 0.40 | 1.10 | Aδ |
| Sensibilità tattile | MDT | 10.20 | 2.50 | Aβ |
| Allodinia meccanica dinamica | DMA | 0.00 | 0.00 | Aβ |
| Sensibilità alla vibrazione | VDT | 6.30 | 1.30 | Aβ |
| Punta Neuropen, singola pressione | MPS | 2.20 | 0.70 | Aδ, C |
| Punta Neuropen, serie | WUR | 1.70 | 0.70 | Aδ, C |
| Dolore da pressione singola | PPT | 4.10 | 1.40 | Aδ, C |
| Dolore esteso da pressione | 4KQ | 4.10 | 1.40 | Aδ, C |
| Algopeg | PEG | 5.70 | 0.65 | Aδ, C |
La procedura di misurazione dura circa 15 minuti per ogni area di test. Può essere facilmente integrata nella pratica quotidiana e aiuta a scegliere metodi terapeutici adeguati, oltre che a valutare il successo del trattamento nell’ambito del ragionamento clinico e dell’educazione del paziente.
Il test clinico sensoriale-nocicettivo è uno strumento utile per misurare e documentare cambiamenti nel sistema somatosensoriale di pazienti con dolore e può migliorare la pratica quotidiana con tali pazienti. I valori di riferimento si basano tuttavia solo su dati provenienti dai gruppi di controllo sani degli studi neurologici e non sono quindi pienamente trasferibili. Come riassume Vollert (2022), è però vero che: «i test sensoriali possono non essere perfetti ma sono il miglior biomarcatore per i fenotipi del dolore di cui disponiamo al momento».
Dworkin, R. H., Turk, D. C., McDermott, M. P., Peirce-Sandner, S., Burke, L. B., Cowan, P., Farrar, J. T., Hertz, S., Raja, S. N., Rappaport, B. A., Rauschkolb, C., & Sampaio, C. (2009). Interpreting the clinical importance of group differences in chronic pain clinical trials: IMMPACT recommendations. Pain, 146(3), 238-244. https://doi.org/10.1016/j.pain.2009.08.019
Forstenpointner, J., Otto, J., & Baron, R. (2018). Individualized neuropathic pain therapy based on phenotyping: are we there yet? Pain, 159(3), 569-575. https://doi.org/10.1097/j.pain.0000000000001088
Koulouris, A. E., Edwards, R. R., Dorado, K., Schreiber, K. L., Lazaridou, A., Rajan, S., White, J., Garcia, J., Gibbons, C., & Freeman, R. (2020). Reliability and Validity of the Boston Bedside Quantitative Sensory Testing Battery for Neuropathic Pain. Pain Med, 21(10), 2336-2347. https://doi.org/10.1093/pm/pnaa192
Magerl, W., Krumova, E. K., Baron, R., Tölle, T., Treede, R.-D., & Maier, C. (2010). Reference data for quantitative sensory testing (QST): Refined stratification for age and a novel method for statistical comparison of group data. Pain, 151(3). https://journals.lww.com/pain/fulltext/2010/12000/reference_data_for_quantitative_sensory_testing.11.aspx
Reimer, M., Forstenpointner, J., Hartmann, A., Otto, J. C., Vollert, J., Gierthmühlen, J., Klein, T., Hüllemann, P., & Baron, R. (2020). Sensory bedside testing: a simple stratification approach for sensory phenotyping. Pain Rep, 5(3), e820. https://doi.org/10.1097/pr9.0000000000000820
Sachau, J., Appel, C., Reimer, M., Sendel, M., Vollert, J., Hüllemann, P., & Baron, R. (2023). Test-retest reliability of a simple bedside-quantitative sensory testing battery for chronic neuropathic pain. Pain Rep, 8(1), e1049. https://doi.org/10.1097/pr9.0000000000001049
Sachau, J., & Baron, R. (2023). Precision Medicine in Neuropathic Pain. Handb Exp Pharmacol, 280, 187-210. https://doi.org/10.1007/164_2023_662
Treede, R.-D. (2013). Quantitative sensorische Testung (QST). In R. Baron, W. Koppert, M. Strumpf, & A. Willweber-Strumpf (Eds.), Praktische Schmerzmedizin: Interdisziplinäre Diagnostik – Multimodale Therapie (pp. 1-11). Springer Berlin Heidelberg. https://doi.org/10.1007/978-3-642-54670-9_9-1
Vollert, J. (2022). Sensory testing might not be perfect – but it is the best biomarker for pain phenotypes we have right now. Scand J Pain, 22(4), 673-675. https://doi.org/10.1515/sjpain-2022-0092
Vollert, J., Maier, C., Attal, N., Bennett, D. L. H., Bouhassira, D., Enax-Krumova, E. K., Finnerup, N. B., Freynhagen, R., Gierthmühlen, J., Haanpää, M., Hansson, P., Hüllemann, P., Jensen, T. S., Magerl, W., Ramirez, J. D., Rice, A. S. C., Schuh-Hofer, S., Segerdahl, M., Serra, J.,…Baron, R. (2017). Stratifying patients with peripheral neuropathic pain based on sensory profiles: algorithm and sample size recommendations. Pain, 158(8), 1446-1455. https://doi.org/10.1097/j.pain.0000000000000935